【皓元·行研】高毒性有效载荷PBD,你知多少?
7月12日,中国国家药监局药品审评中心(CDE)官网公示,ADC Therapeutics和瓴路药业联合申报了注射用泰朗妥昔单抗(Loncastuximab tesirine)的上市申请,并获得受理。Loncastuximab tesirine是国内首款靶向CD19的抗体偶联药物(ADC)。
当Loncastuximab tesirine与表达CD19的肿瘤细胞结合时,会被细胞内化,随后释放吡咯并苯二氮杂䓬二聚体(PBD Dimer)细胞毒素。该毒素能不可逆地与DNA小沟相结合,并且形成高强度的链间交联,从而破坏复制等必要的DNA代谢过程,进而诱导细胞死亡。这一独特的作用机制,使得PBD dimer引起了大众的关注。
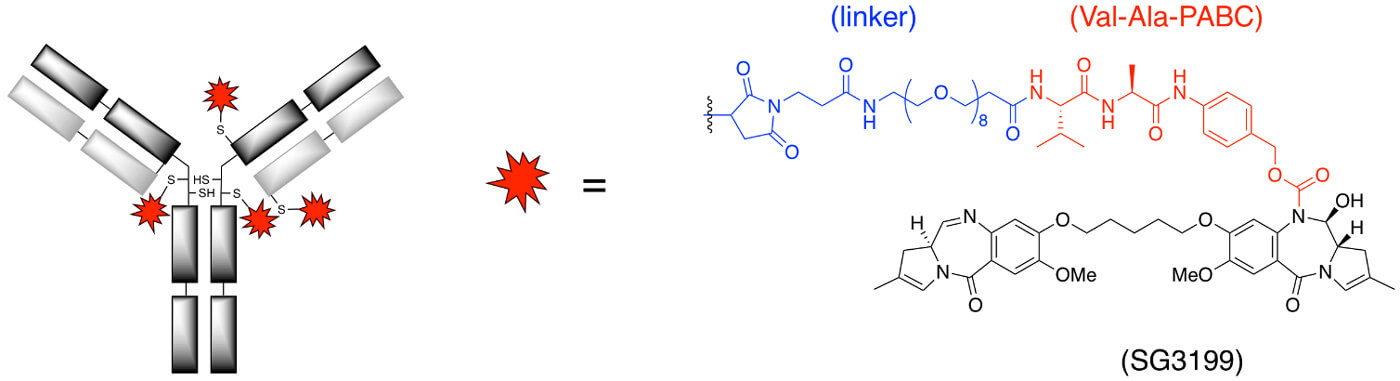
▲ Fig.1 Loncastuximab tesirine中连接子和有效载荷PBD的结构[11]
PBD简介
吡咯并苯二氮杂䓬(PBD)是一种序列选择性的DNA小沟结合剂,是抗生素炭疽霉素家族中的一员。[1]此外,科学家们还发现,通过亚甲基链将两个PBD单元连接在一起,可以使PBD二聚体与DNA之间产生高度致命的链间交联。而且这种PBD二聚体在多种肿瘤细胞系中的活性可达到 pmol/L的水平。[2-3]
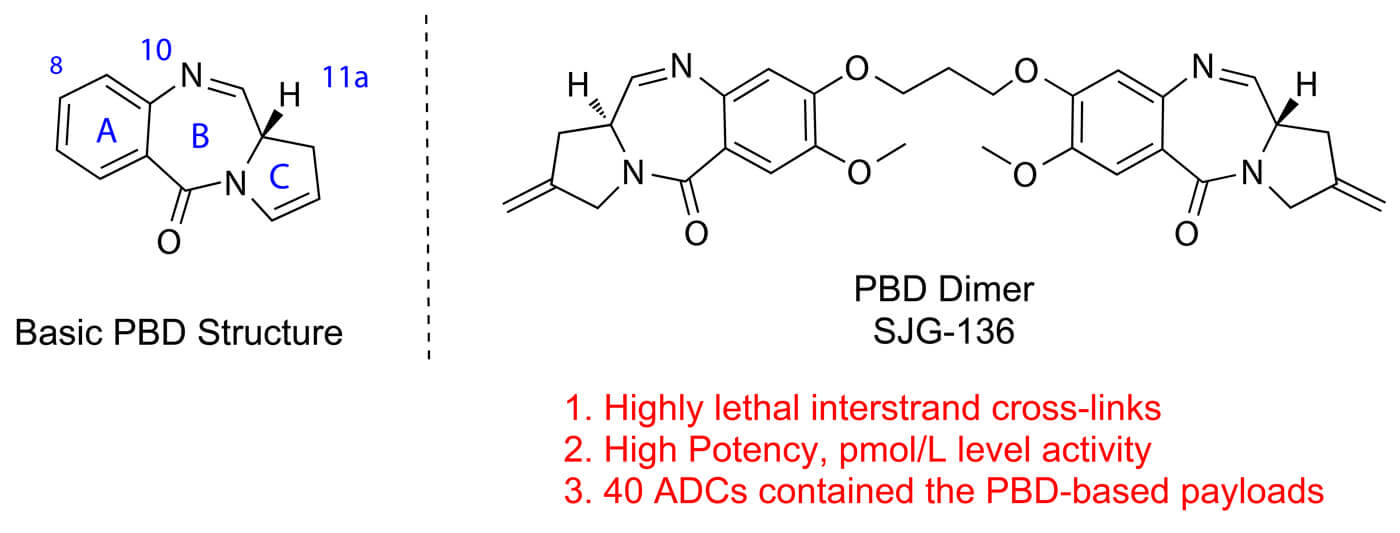
▲ Fig.2 PBD药效团与PBD二聚体的结构
PBD的构效关系
PBD的骨架结构包含一个有取代基的芳香环A、一个二氮杂环B和一个吡咯环C,在B环和C环之间的C11a位置有一个S手性中心。PBD单体通过C8/C8'-位置连接在一起,形成PBD二聚体。
下文概述了PBD二聚体的主要构效关系特征。一般来说,A环的官能化、C环的取代和不饱和度以及两个PBD单元之间的修饰都会影响PBD二聚体与DNA结合能力和细胞毒性。[4-8]
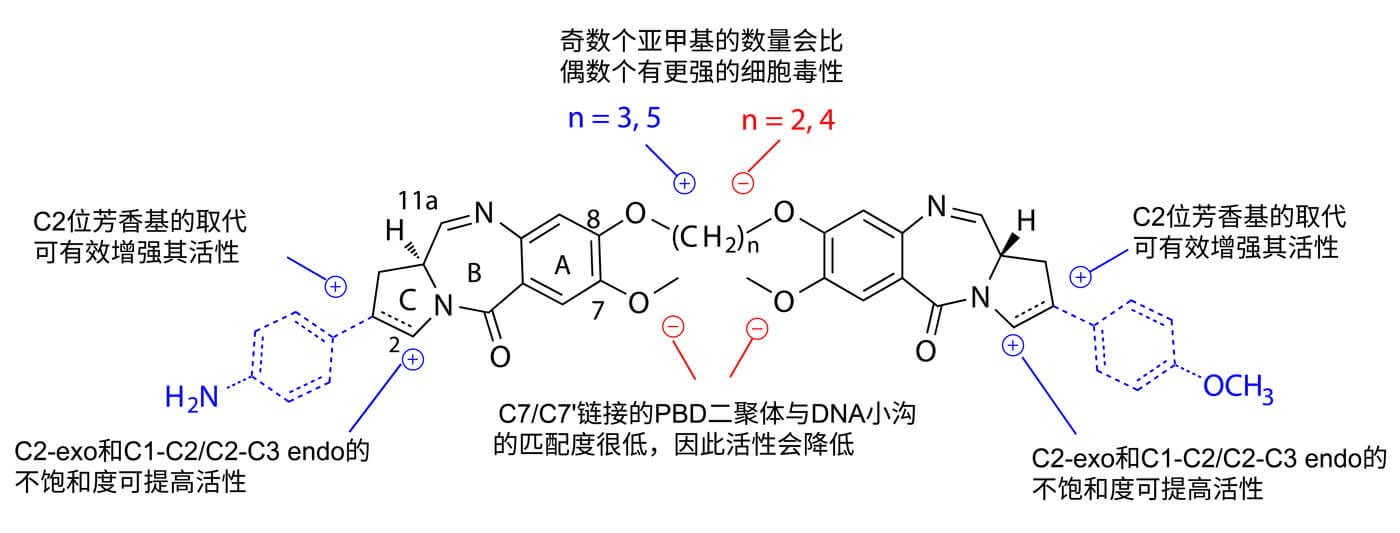
▲ Fig. 3 PBD二聚体的结构-活性关系
提高活性的修饰用蓝色表示
降低活性的修饰用红色表示[9]
PBD作为有效载荷的特点
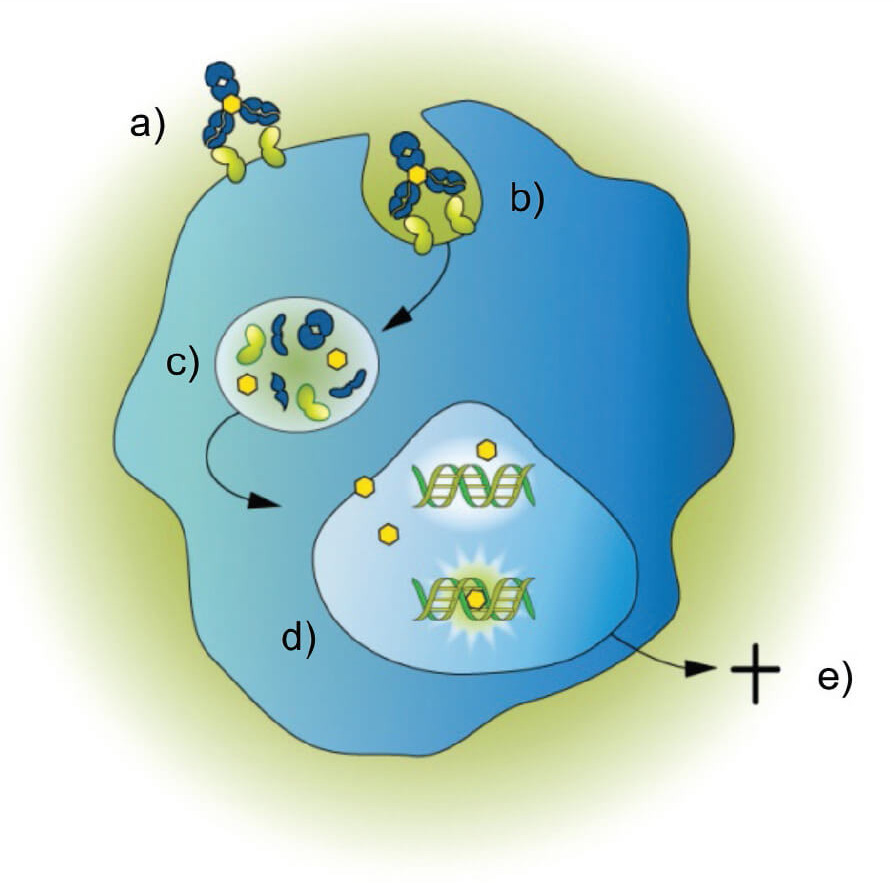
▲ Fig.4 PBD二聚体的ADC作用机制的主要步骤是:(a) 与细胞表面的抗原靶点结合;(b) 内化到细胞中;(c) 转运到溶酶体,在溶酶体中发生连接体裂解,释放出游离的 PBD二聚体;(d) PBD二聚体与DNA小沟结合,产生细胞毒性DNA损伤;(e) 一系列细胞事件导致细胞死亡[3]
毒性高、结构简单:由于其极高的活性,可以构建药物抗体比(DAR)较低的ADC;其结构简洁,与auristatins和maytansinoids相比,可以通过更简单快速的方法实现其放大量生产。
在细胞中的持久性:PBD二聚体产生的DNA链间交联在结构上不会扭曲DNA的结构,这可以有效的规避DNA的自动修复机制而使其在细胞中持续存在。[2]这不仅提高了它们的效力,还使它们能够影响增殖缓慢的靶细胞。
高效旁观者效应:具有PBD的ADC可在体外和体内有效杀死旁观细胞。PBD二聚体的半衰期很短,其极短的半衰期可确保药物在血液循环中的过早释放不会导致药物蓄积到引起全身毒性的水平。[10]
ADC 领域药物作用的新机制:它利用了与微管蛋白抑制剂类完全不同的细胞靶点,以及与calicheamicin等他 DNA 相互作用弹头不同的DNA损伤模式。
PBD在ADC管线中的应用

参考文献:
[1] J. Am. Chem. Soc. 1965, 87, 5791-5793.
[2] Cancer Res. 2004, 64, 6693-6699.
[3] Expert Opin. Investig. Drugs 2011, 20, 733-744.
[4] J. Med. Chem. 2001, 44, 737-748.
[5] J. Med. Chem. 1994, 37, 4529-4537.
[6] Pharm. Pharmacol. Commun. 1999, 5, 555-560
[7] Blood 2013, 122, 1455-1463
[8] Bioorg. Med. Chem. 2007, 15, 3041-3053
[9] Angew. Chem. Int. Ed. 2017, 56, 462-488
[10] Mol Cancer Ther. 2016, 15, 2709–2721.
[11] Beacon Data Base


