【皓元·行研】双载荷ADC——解决ADC药物耐药性新策略
抗体-药物偶联物(ADC)是一类抗体治疗方法,利用单克隆抗体的特异性传递有效载荷到靶细胞。近年来ADC领域的快速发展和广泛应用为患者提供了新的治疗选择,但大多数肿瘤最终会对这些药物产生耐药性。耐药性是系统性癌症化疗长期存在的问题,鉴于ADC的复杂性,人们提出了针对ADC不同成分的耐药机制,其中包括:涉及抗原表达减少、ADC转运和处理能力下降、细胞毒性有效载荷的抗药性以及药剂流出细胞的增加等机制[1]。人们一直尝试用多种药物联合治疗的方法来降低耐药的概率或减缓耐药的速度[2]。事实上,目前的化疗方案通常也会使用多种药物组合的方式。考虑到联合化疗的益处,使用具有两种或多种有效载荷的ADC或许可以避免ADC产生耐药性[3-8]。
相比于传统的ADC药物,双载荷ADC目前主要的构建方法是:1.在抗体的同一位点引入分支linker,再通过点击反应引入有效载荷;2.在抗体的不同位点引入单链linker和有效载荷。
双载荷ADC文献汇总[3-8]
2016, 中科院上海药物所
该专利提供了一种寡糖连接子的制备方法,并运用该连接子和定点偶联方法成功构建了一个双载荷ADC。
2017, Seattle Genetics
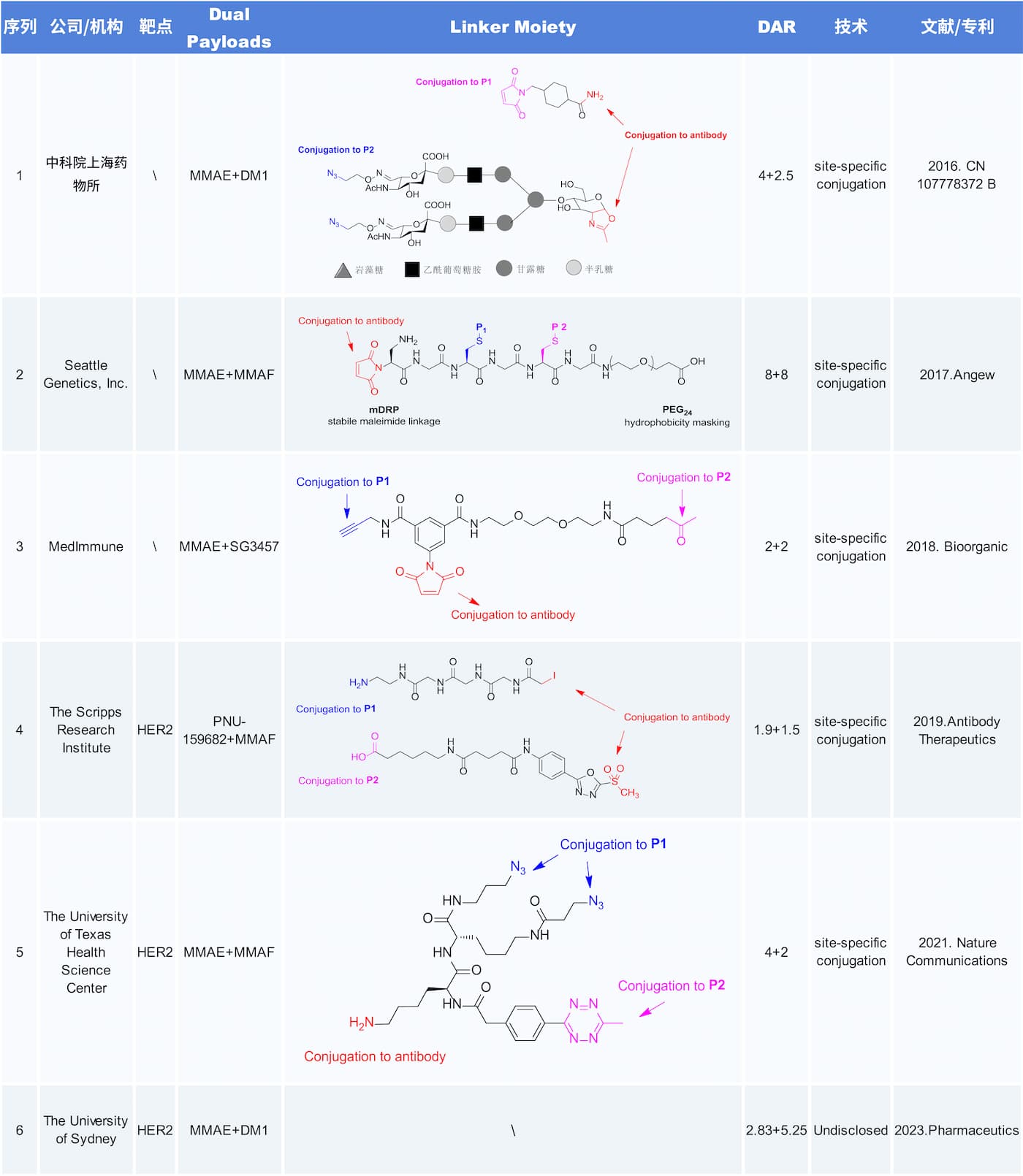
该文献开发了一种通过对半胱氨酸正交保护的方法,实现了有效载荷的特异性偶联;
尽管MMAE和MMAF作用于相同的细胞内靶点,但通过体内外实验可观察到其不同的作用:MMAF有效载荷能保持对具有上调外排泵的靶细胞的细胞毒性,而可裂解连接体上的 MMAE则能产生旁观者效应,杀死不表达靶细胞表面抗原的共培养细胞。
2018, MedImmune

成功构建了一个”heterotrifunctional linker”的平台,该平台可连接多种有效载荷以构建双载荷ADC;
通过体外实验证明了其双载荷ADC的活性以及该平台的可行性。
2019, The Scripps Research Institute
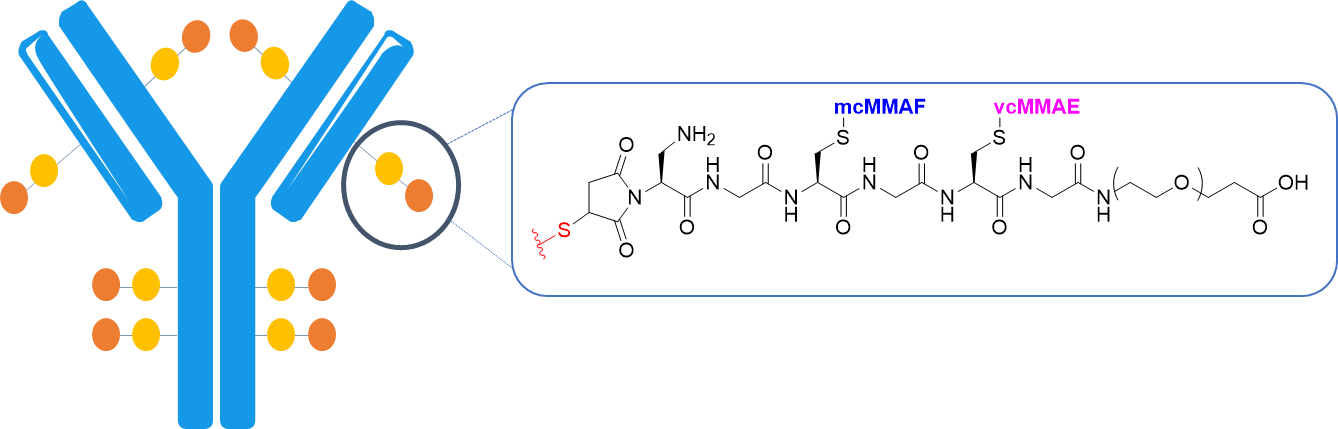
DNA交联剂PNU-159682和微管蛋白聚合抑制剂MMAF通过工程化的硒代半胱氨酸和半胱氨酸残基与HER2靶向抗体特异性结合;
双载荷ADC对表达HER2的细胞株具有选择性和强效细胞毒性,并表现出与所附药物一致的双重作用机制。PNU159682因其DNA损伤活性而导致S期细胞周期停滞,而MMAF则同时抑制微管蛋白聚合并导致G2/M期细胞周期停滞。
2021, The University of Texas Health Science Center
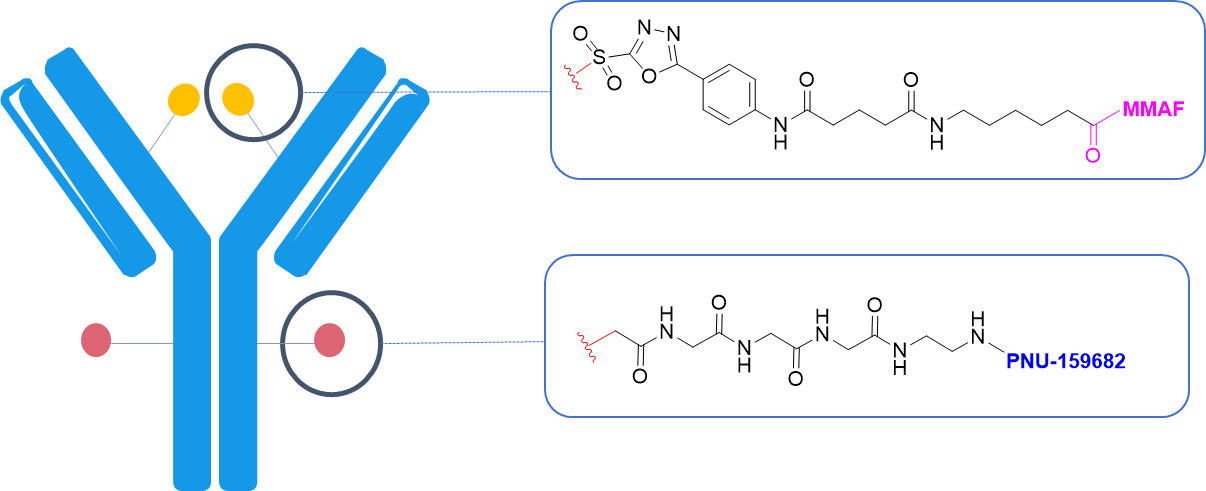
通过化学酶偶联方法,成功构建出2+2、2+4和4+2的双载荷ADC;
该双载荷ADC在代表肿瘤内HER2异质性和耐药性增强的异种移植小鼠模型中,显示出了比同时服用两种单药更强的治疗效果和生存益处,凸显了其在治疗难治性乳腺癌以及其他癌症方面的治疗潜力。
2023, The University of Sydney
通过vcMMAE和SMCC-DM1与人源化抗HER2的抗体结合,成功构建双载荷ADC,Tmab-VcMMAE-SMCC-DM1;
通过体外实验证明了其拥有很强的细胞毒性,并且该两个有效载荷可以展示出协同作用。
双载荷ADC管线
2023年AACR会议上,启德医药公开了其一条双载荷ADC的管线,该管线具有两种不同作用机制的有效载荷,该管线是基于其独特的酶定点共轭技术iLDC/iGDC构建的双载荷ADC,通过这两个载荷的协同作用增强了体外和体内的免疫原性细胞死亡(ICD)和抗肿瘤反应。

参考文献:
[1]Cancers 2023, 15, 1278;
[2]Cancers 2014, 6, 1769;
[3]Angew. Chem. Int. Ed. 2017, 56, 733;
[4]Bioorganic & Medicinal Chemistry Letters 2018, 28, 3617;
[5]Antibody Therapeutics 2019, 1
[6]Nature Communications 2021, 12, 3528
[7]Pharmaceutics 2023, 15, 2020
[8] CN 107778372 B 2016


